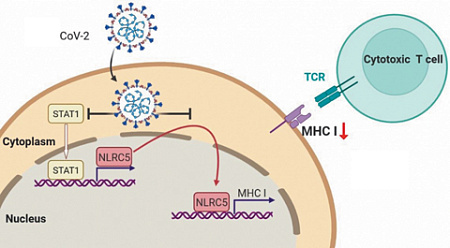
 Иммунный стресс, вызванный атакой ковидной клетки. Справа она предъявляет вирусный антиген с помощью мембранного белка МНС (большого комплекса гистосовместимости). Чужеродность антигена определяется парным белковым рецептором Т-лимфоцита (TCR). Иллюстрация Physorg
Иммунный стресс, вызванный атакой ковидной клетки. Справа она предъявляет вирусный антиген с помощью мембранного белка МНС (большого комплекса гистосовместимости). Чужеродность антигена определяется парным белковым рецептором Т-лимфоцита (TCR). Иллюстрация Physorg
Ко времени событий Французской революции ученые и философы, думавшие о том, как меняется живой мир, разделились на два лагеря. Барон Ж. Кювье постулировал идею катастрофизма, ссылаясь на находки гигантских костей вымерших животных. Ж.-Б. Ламарк ратовал за постепенность развития, дав для ее определения слово evolution. Корень vol – со значением поворота и незамкнутого круга (вот еще несколько однокоренных слов: «вальс», «револьвер», «эвольвента»).
Ламарк первым «произвел» человека от обезьяны, «давшей» и шимпанзе, с которой у людей много общего (на уровне геномов сходство оказалось более 90%). Разделяют два вида какие-то 25 млн лет, даже вирусы иммунодефицита у них оказались практически одинаковыми. Считается, что предки людей получили вирус от обезьян, потому что геном ВИЧ мало чем отличается от SIV (Simian Immunodeficit Virus).
Приобретенный дефицит развивается как следствие вирусной атаки мечниковских макрофагов, предъявляющих «чужие» антигены, и лимфоцитов Т-хелперов, помогающих запустить иммунный ответ. Это, так сказать, адаптивный иммунитет, возникающий в результате приспособления системы с ее иммунными В и Т лимфоцитами к антигенам разного происхождения. Но это лишь вторая линия обороны. Первая же – врожденный, или innate, иммунитет. Он вступает в действие с первого же момента встречи с опасностью.
Оба вида иммунитета зависят от белковых антител разной специфичности. Оба вида клеток-эффекторов имеют на своей поверхности белковые рецепторы, соответственно TCR и BCR. Каждый имеет по две большие, тяжелые цепи, гены которых, постоянно «тасуясь», рекомбинируют. Этим они обеспечивают достойную встречу любому антигену.
В самой генетической рекомбинации нет ничего удивительного. Так, в ходе клеточного деления обмениваются своими участками (рекомбинируют) хромосомы отца и матери. К сожалению, это делает невозможным пересадку органов и тканей между родителями и их детьми, так как их комбинации рецепторов делают клетки иммунологически несовместимыми…
Чуть более полувека назад в Москве был основан Медико-генетический центр, специалисты которого проверяют кровь каждого младенца страны с целью выявления наследственных заболеваний (в 2023 году обнаружили чуть более 600). Эпидемия ВИЧ способствовала прогрессу иммунологии. Было установлено, что антигены и антитела синтезируются во всем их разнообразии под действием белка RAG (Recombination Activating Gene – ген, активирующий рекомбинацию). Стало ясно, что ВИЧ не «изобрел» ничего нового. Скажем, у беременных тоже частично возникает «приобретенный» иммунодефицит, препятствующий «сбросу» плода, который геномно наполовину чужероден матери. Выяснилось также, что некоторые дети рождаются с тяжелой формой комбинированного иммунодефицита (SCID), вызванного отключением гена RAG вследствие его мутации.
Исправить ситуацию в лабораторных опытах на мышах решили в Научном институте Сан-Рафаэле Милана (STM, TS). С этой целью ученые предприняли генетическое редактирование, которое уже одобрено для пациентов с серповидно-клеточной анемией (СКА) и бета-талассемией. Эти гемоглобинопатии есть результат нарушений двух генов, мутации которых защищают от малярии. Сейчас имеется несколько подходов к генетическому редактированию, один из которых у мышей с моделью SCID был применен в Милане. Ген RAG «исправили» в клетках, полученных от пациента с врожденным иммунодефицитом, которые затем ввели мышам.
Суть необычного феномена заключается в том, что редактировать для восстановления функции иммунной системы нужно было всего 10% стволовых клеток костного мозга. Теперь необходимо удостовериться в «пригодности» метода и его безопасности, а также найти пути быстрого масштабирования клеточной массы, что пока занимает много времени и довольно дорого. По поводу этого авторы говорят, что они «преданы трансляции нашей стратегии для клиники». Этому может помочь новая микроскопия, в деталях показывающая продукцию клеток крови в костном мозге и его ответ на такие стрессоры, как кровотечение и инфекция.
И вот совсем недавнее сообщение в журнале Nature. Группа хирургов из Медицинского университета китайской провинции Сиань пересадила человеку (клинически мертвому) печень генетически модифицированной свиньи. Эти донорские клетки не вызвали отторжения. Эксперимент из этических соображений, хотя было получено информированное согласие родственников, был свернут через 10 дней.