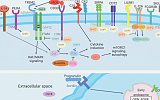
 Аномальное возбуждение нейронов гиппокампа, проявляющее себя припадком. Иллюстрация Physorg
Аномальное возбуждение нейронов гиппокампа, проявляющее себя припадком. Иллюстрация Physorg
Для изучения мозга Владимира Ленина в 1925 году в Москве был учрежден особый институт во главе с немецким морфологом и неврологом Оскаром Фогтом. Он проработал в Институте мозга до 1930 года. Главным «орудием труда» в то время был гигантский по сегодняшним представлениям микротом (инструмент для приготовления срезов биологических тканей и небиологических образцов).
Микротом Фогта был размером с хороший рабочий стол. С его помощью удалось сделать более 2000 срезов ленинского мозга. Результаты микроскопического их изучения были представлены московскому партактиву 10 мая 1934 года. Главный итог – выявление большего числа нейронов и их связей в третьем слое лобной коры вождя. Умер Фогт в 1959-м, ему шел 91-й год.
Все мы знаем о том, как важно поддерживать нервное здоровье. Мозгу вредит информационная перегрузка на фоне гиподинамии. Особенно если отмечаются такие факторы риска, как повышенное давление и содержание холестерина и глюкозы в крови. Противоядие этому – физкультура.
Микробиомом занимался еще Роберт Кох, открывший туберкулезную палочку, за что был удостоен Нобелевской премии. На следующий год после российского академика Ивана Павлова, детально описавшего пищеварительный рефлекс, а затем раскрывавшего тайны мозгового возбуждения и охранительного торможения. После Коха из Стокгольма пришло приглашение итальянцу Камилло Гольджи и испанцу Сантьяго Кахалу, яростно споривших об организации нервного строения. Уроженец Аппенин доказывал, что одна нервная клетка плавно «перетекает» в другую (как в мышце, где клетки сливаются друг с другом). А горячий идальго на основе своих препаратов доказывал, что нейроны автономны.
Спор утих после открытия синапсов, или точек нейрональных контактов. А в 1959 году было показано, что они бывают двух видов. Затем было выяснено, что в «точках» возбуждения в синапсическую щель из пресинаптического окончания выделяется глютаминовая аминоксилота (Глю), а в тормозящих – гамма-аминомасляная кислота (ГАМК), которая широко используется для введения человека в терапевтическую кому.
Сегодня в распоряжении нейробиологов несравненно больше методов исследования молекулярных структур синапсов. Один из недавно предложенных корейскими биоинженерами использует MOFs – Metal-Organic Frames: гибридные пористые материалы с ионами металлов и органикой. Пористая структура улавливает молекулы, после чего удерживает их в нанолунках. Это облегчает проведение молекулярного анализа. Метод позволяет автоматически прослеживать превращение нервных стволовых клеток в функциональные нейроны. Авторы этой работы, опубликованной в журнале Science Advances, подчеркивают, что эффективность процесса удалось повысить в 40 раз.
Другой метод связан с определением белков в ингибирующем синапсе и использует бактериальный фермент, который прочно связывается с протеинами, удерживая их для анализа. Ученые, занимающиеся изучением протеинов из университета Дьюка в г. Дареме (США), выявили в синапсах 140 белков, 27 из которых уже «засветились» при аутизме, умственной отсталости и эпилепсии. Два варианта ингибирующего протеина синапсов с неизвестной функцией авторы назвали InSyn 1 и 2. Нехватка первого из них приводит к эпилептическому перевозбуждению нейронов гиппокампа, или извилины морского конька. Работа опубликована в журнале Science.
Выводы коллег подтвердили в Институте науки и технологии корейского г. Тэгу. «Щель» по-английски – slit. Поэтому неудивительно, что авторы назвали свой энзим SLITRK (SLIT Receptor Kinase), или рецепторная киназа синаптической щели. Рецепторами называются белки клеточных оболочек, а киназы «кинируют» – переносят энергоемкие фосфатные группы, регулируя тем самым белки.
Корейцы описали сложный набор белков синапса, прочность которого «укрепляется», в частности, постсинаптической SLITRK. Она взаимодействует с пресинаптическим ферментом фосфатазой, которая поднимает энергетический уровень пресинаптического бета-катенина и кадгерина. Первый участвует в созревании нейронов, а второй связывает возбуждающие ионы кальция. Работа этого комплекса способствует выбросу в синаптическую щель нейромедиаторов. А вот сбой в этом молекулярном механизме ведет к нейродегенеративным заболеваниям, таким как эпилепсия, например.