 Переплетение серебряных нанопроволок на кремниевом чипе моделирует процесс передачи нервного сигнала в мозге. Иллюстрации Physorg
Переплетение серебряных нанопроволок на кремниевом чипе моделирует процесс передачи нервного сигнала в мозге. Иллюстрации Physorg
Растущую угрозу нейродегенеративных заболеваний в стареющем мире печальным образом отражает анекдот: «Я рад, что вы больны не мной. Альцгеймер». Некоторые исследователи видят причину поражений нейронов в наследстве, доставшемся нам от пещерных предков.
Археологи австралийского Университета Гриффита объявили, что нашли в одной из пещер индонезийского острова Сулавеси прекрасное изображение быка, нарисованное 44 тыс. лет назад. Об этом пишет журнал Nature. Через неделю их соотечественники из Сиднейского университета вместе с коллегами из Университета Айовы (США) сообщили в том же издании, что Homo erectus жил в пещере Ндандон на острове Ява 117 –108 тыс. лет назад и, возможно, контактировал с денисовцами, пришедшими с севера. Во вступлении говорится, что это еще не человек, а гоминид. Денисовцы пришли и на острова Меланезии. У их жителей до сих пор сохраняется наибольший процент денисовских генов. К сожалению, все эти вида Homo вымерли.
Журнал New Scientist вновь обратился к старой как мир проблеме того, что определяет наше развитие – природа или «вскармливание. Психолог Элисон Гопник из Калифорнийского университета в Беркли (США) для решения этого спора, тянущегося с античных Афин, привлекает методы эпигенетики. Напомним, эпигенетика подразумевает химическое добавление метильных групп –СН3 к ДНК без изменения ее «текстов». И это меняет характер осуществления инструкций, записанных в генах. В качестве примера психолог, занимающаяся развитием мышления, приводит пары однояйцовых близнецов, вырастающих в одной семье совершенно разными людьми, а в других случаях – когда их разделили при рождении – удивительно сходными личностями.
Нанотехнологии все активнее вторгаются в биологию. Разработанные на ее основе устройства по своим размерам становятся намного меньше клеточных размеров. Инженеры Калифорнийского университета в Лос-Анджелесе создали путем самосборки на кремниевом чипе «войлок» (mesh) из серебряных проволочек диаметром 350 нанометров (нм), покрытых изолирующим полимером толщиной 1 нм.
В местах контактов проволочек при подаче напряжения атомы серебра начинают «перетекать» из одной в другую, имитируя тем самым электрохимическую передачу в нервных синапсах (точках нейрональных контактов). Устройство площадью 10 кв. мм показывает «поведение» нейросети в возбужденном состоянии. После отключения это состояние «гаснет», тем самым стирая память. При низком напряжении нанопроволочная система переходит в сонное состояние, которое сходно с тем, что наблюдается при МРТ у спящих людей.
Более 110 лет причину развития болезни Альцгеймера связывают с отложениями нейротоксичного бета-амилоида в виде бляшек. В результате нарушается передача сигналов в синапсах и погибают нервные клетки. Однако коллеги Альцгеймера возражали ему, поскольку видели бляшки и в мозге пожилых людей, деменцией не страдавших.

|
|
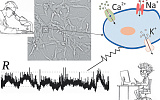
Длина хвоста РНК (красная) может повышать токсичность тау- белка. Иллюстрации Physorg |
Альтернативное направление ученой мысли связано с другим аномальным протеином, получившим название «тау» (tau) в силу того, что образует сплетения, клубки, также обладающие нейротоксическим действием. Оно, в частности, было показано у почвенных червячков C. elegans, достигающих зрелости через три дня. Нейроны этих нематод гибнут в результате мутации гена sut (suppressor of tautopathy), который в норме подавляет таутопатию. Тот же ген имеется и у человека, и у мышей, поэтому его называют MSUT (М – от слова «млекопитающие»).
Но не все так просто, как выяснили сотрудники гериатрического центра Вашингтонского университета в г. Сиэтле (США). Свою статью в журнале Science они начали с того, что сегодня не существует эффективного лечения болезни Альцгеймера и сходных с нею расстройств, характеризующихся дефицитом памяти и способности к обучению. Свое понимание процессов ученые изучили на двух мышиных моделях, в одной из которых было повышенное отложение тау-белка на фоне отключения гена MSUT.
Оказалось, что MSUT взаимодействует еще с одним протеином PABPN (PolyAdenyl Binding Protein Nuclear), который связывает в ядре адениновые хвосты РНК (аденин – одна из «букв» генетического кода). Таким образом, выяснилась и роль РНК в патологии. Оба белка играют «оппозицинные» роли в образовании тау-клубков. Возможно, что именно этим объясняется предполагаемая роль вируса герпеса (весенней лихорадки), который, подобно ВИЧ, «прячется» от иммунных клеток в ядре нейронов, нарушая синтез РНК в нем и вызывая воспаление белой ткани.
Новые открытия усложнили картину, но в то же время выявили две новые мишени для будущих лекарств.



























комментарии(0)