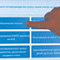
Альфа-спирали синуклеина, образующие кольцевидную структуру в мембране нейрона.
Иллюстрация Physorg
Альфа-спирали синуклеина, образующие кольцевидную структуру в мембране нейрона.
Иллюстрация Physorg
Реклама навязчиво призывает нас «чинить» мембрану-оболочку печеночных клеток. Мембрана с обеих сторон имеет «любящий воду» гидрофильный фосфор, а между – гидрофобные жирные кислоты. В результате клетка надежно защищена от проникновения всякого рода веществ. Но общение с внешним миром все же происходит благодаря большим протеиновым комплексам, встроенным в клеточную оболочку.
Для поступления воды служат полые «поры», или аквапорины. Для выведения токсических веществ – мультилекарственные «насосы» (MDR – Multi-Drug Resistance), благодаря которым возникает раковая резистентность к химиотерапии.
К синапсу – точке соединения нервных клеток – подходят пузырьки с адреналином или ацетилхолином. При этом возникает пора, через которую нейромедиатор выходит в щель и соединяется со своим рецептором, что приводит к открытию ионного канала. Поступление ионов в нервную клетку приводит к ее возбуждению или торможению.
То же самое можно видеть на примере родопсина палочек и колбочек сетчатки глаза. Для доставки жизненно важных веществ в клетки служат также белки-транспортеры. Бактерии протыкают свои клеточные жертвы с помощью больших протеиновых «шприцев».
Можно также упомянуть белок перфорин, с помощью которого иммунные клетки наносят самые настоящие «пробоины» в мембранах клеток-мишеней. Диаметр этих перфораций достигает 50–100 нм (нанометров), в то время как сечение протеиновых каналов не превышает нескольких нанометров.
Все эти общие соображения хорошо иллюстрируются последними исследованиями альфа-синуклеина (aSyn). Роль и функция этого белка в здоровых нервных клетках до сих пор неясна. Однако известно, что его молекулы могут полимеризоваться в виде кольцевой структуры из альфа-спиралей, откуда и его название. И эти структуры способны встраиваться в мембрану нейрона. Возникновение этой аномальной поры приводит к гибели нервных клеток, поэтому aSyn считается одной из причин возникновения семейной формы болезни Паркинсона и других нейродегенеративных заболеваний.
Формирование этой кольцевой структуры синуклеина было показано сотрудниками Калифорнийского университета Сан-Диего Игорем Цигельным, Юрием Шариковым и Валентиной Кузнецовой. Результаты их работы представлены в Журнале химического общества (ACS).
В университете Цюриха и Техническом университете Дортмунда провели рентгеноструктурный анализ синуклеина, «погруженного» в двойной липидный (жировой) слой, располагавшийся на кремниевой подложке. Это позволило ученым проследить за изменениями в мембране по ходу встраивания в нее синуклеина. В своей статье в том же журнале ACS авторы пишут, что «пружины» альфа-спиралей мутантного протеина буквально сжимают жировой бислой, толщина которого уменьшается.
Ничего подобного не происходит с мембраной, формирующейся путем самосборки на золотой подложке, в которую ученые Калифорнийского университета в Лос-Анджелесе встроили белковый рецептор серотонина, который называют веществом хорошего настроения. Такая искусственная система хорошо распознает малые молекулы нейротрансмиттера и, по словам авторов, является хорошей платформой для определения уровня серотонина у здоровых людей и пациентов.
Необходимость выявления минимальных количеств биомолекул видна и в случае определения интерлейкина, известного стимулятора иммунного ответа, служащего для передачи сигналов между лейкоцитами и лимфоцитами, а также нейропротектором, защищающим нервные клетки после нейротравм. Однако уровень иммуноактивного протеина не должен превышать определенного порога. В чрезмерных количествах белок может вызывать плохо контролируемое воспаление, усугубляющее патологический процесс. Результаты этого исследования, проведенного в университете штата Вирджиния, опубликованы в журнале J. Clin. Invest. Тут мы, как всегда, сталкиваемся с дуалистичностью жизненных процессов.